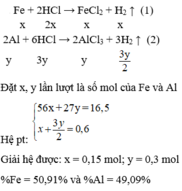Hòa tan 2.22 g hỗn hợp Al và Fe bằng 500 ml dung dịch HNO3 0.5M thu được dung dịch A và 1.12 (l) duy nhất NO ở đktc a.Tính % khối lượng mỗi kim loại trong hỗn hợp đầu b Cho A tác dụng 210 ml dung dịch NaOH 1M. Rồi lấy kết tủa đem nung ở nhiệt độ cao được bao nhiêu g chất rắn

Những câu hỏi liên quan
2. Hòa tan 2.22 g hỗn hợp Al và Fe bằng 500 ml dung dịch HNO3 0.5M thu được dung dịch A và 1.12 (l) duy nhất NO ở đktc
a.Tính % khối lượng mỗi kim loại trong hỗn hợp đầu
b Cho A tác dụng 210 ml dung dịch NaOH 1M. Rồi lấy kết tủa đem nung ở nhiệt độ cao được bao nhiêu g chất rắn
NO3- + 4H+ + 3e ---> NO + 2H2O
nNO = 1.12 / 22.4 = 0.05 mol => nH+ = nHNO3pư = 0.2 mol
nHNO3 đầu = CV = 0.5 x 0.5 = 0.25 mol > 0.2 mol
Vậy HNO3 dư và Al, Fe tan hết. nHNO3 dư = 0.25 - 0.2 = 0.05 mol
Đặt x = nAl, y = nFe: => 27x + 56y = 2.22g
Al - 3e ---> Al3+ và Fe - 3e ---> Fe3+
x.....3x.....................y......3y
=> ne cho = 3x + 3y (mol) => nNO = x + y = 0.05 mol
Giải hệ: x = 0.02 mol; y = 0.03 mol
=> %Al = 0.02 x 27 x 100 / 2.22 = 24.3244% => %Fe = 75.6757%
ddA chứa: Al3+ 0.02 mol, Fe3+ 0.03 mol, HNO3 dư 0.05 mol => số mol ion dương = 0.2 mol
nNaOH = nOH- = 0.21 mol > 0.2 mol. Vậy OH- dư, nOH- dư = 0.21 - 0.2 = 0.01 mol
Fe(OH)3 kết tủa trước vì Fe(OH)3 có tích số tan lớn hơn nhiều Al(OH)3.
Fe3+ + 3OH- ---> Fe(OH)3
nFe(OH)3 = nFe3+ = 0.03 mol
Al3+ + 3OH- ---> Al(OH)3 (1)
nAl(OH)3 (1) = nAl3+ = 0.02 mol
Al(OH)3 + OH- ---> (AlO2)- + 2H2O
nOH- = 0.01 mol => nAl(OH)3 tan = 0.01 mol => nAl(OH)3 còn lại = 0.02 - 0.01 = 0.01 mol
Chất rắn còn lại: Fe(OH)3 0.03 mol, Al(OH)3 0.01 mol
2Fe(OH)3 ---> Fe2O3 + 3H2O...........2Al(OH)3 ---> Al2O3 + 3H2O
0.03.................0.015...............
m (oxit) = 0.015 x 160 + 0.005 x 102 = 2.91g
Đúng 0
Bình luận (1)
Hòa tan 2.22 gam hỗn hợp Al và Fe bằng 500ml dung dịch HNO3 0.5M thu được dung dịch A và 1.12 lit khí duy nhất NO (đktc).
a) Tính % về khối lượng mỗi kim loại trong hỗn hợp đầu?
b)Cho dung dịch A tác dụng với 210ml đ NaOH 1M, rồi lấy kết tủa nung ở nhiệt độ cao thì thu được bao nhiêu gam chất rắn?
a, nNO=1.1222.4=0.05(mol)1.1222.4=0.05(mol)
Gọi nAl=a(mol)
.....nFe=b(mol)
Ta có 27a + 56b = 2.22(g) (*)
Quá trình cho e
AlO.................➞ Al+3 + 3e
a......................................3a(mol)
FeO.................➞ Fe+3 + 3e
b......................................3b(mol)
Quá trình nhận e
N+5 + 3e ➞..N+2
.........0.15.....0.05 (mol)
Áp dụng định luật bảo toàn electron ta có
3a + 3b = 0.15(**)
Giải (*) và (**) ta được a=0.02(mol),b=0.03(mol)
%Al=0.02∗272.22∗1000.02∗272.22∗100%=24.324%
%Fe=100%-24.324%=75.676%
b, ddA chứa: Al3+ 0.02 mol, Fe3+ 0.03 mol, HNO3 dư 0.05 mol => số mol ion dương = 0.2 mol
nNaOH = nOH- = 0.21 mol > 0.2 mol. Vậy OH- dư, nOH- dư = 0.21 - 0.2 = 0.01 mol
Fe(OH)3 kết tủa trước vì Fe(OH)3 có tích số tan lớn hơn nhiều Al(OH)3.
Fe3+ + 3OH- ---> Fe(OH)3
nFe(OH)3 = nFe3+ = 0.03 mol
Al3+ + 3OH- ---> Al(OH)3 (1)
nAl(OH)3 (1) = nAl3+ = 0.02 mol
Al(OH)3 + OH- ---> (AlO2)- + 2H2O
nOH- = 0.01 mol => nAl(OH)3 tan = 0.01 mol => nAl(OH)3 còn lại = 0.02 - 0.01 = 0.01 mol
Chất rắn còn lại: Fe(OH)3 0.03 mol, Al(OH)3 0.01 mol
2Fe(OH)3 ---> Fe2O3 + 3H2O...........2Al(OH)3 ---> Al2O3 + 3H2O
0.03.................0.015...............
m (oxit) = 0.015 x 160 + 0.005 x 102 = 2.91g
Đúng 0
Bình luận (0)
Cho a gam hỗn hợp A gồm AL,Fe,Cu tác dụng với H2SO4 loãng dư thu được 952 ml H2. Mặt khác cho 2a gam hỗn hợp A tác dụng với NaOH dư thấy còn lại 3.52 gam kim loại không tan . Cho 3a hỗn hợp A tác dụng với 400 ml dung dịch HNO3 1.3 M thấy giải phóng V lít khí NO duy nhất và được dung dịch D . Lượng HNO3 dư trong dung dịch D hòa tan vừa hết 1 gam CaCO3 . tính số gam mỗi kim loại trong A và tính V . biết thể tích khí đo ở đktc .
Đọc tiếp
Cho a gam hỗn hợp A gồm AL,Fe,Cu tác dụng với H2SO4 loãng dư thu được 952 ml H2. Mặt khác cho 2a gam hỗn hợp A tác dụng với NaOH dư thấy còn lại 3.52 gam kim loại không tan . Cho 3a hỗn hợp A tác dụng với 400 ml dung dịch HNO3 1.3 M thấy giải phóng V lít khí NO duy nhất và được dung dịch D . Lượng HNO3 dư trong dung dịch D hòa tan vừa hết 1 gam CaCO3 . tính số gam mỗi kim loại trong A và tính V . biết thể tích khí đo ở đktc .
Câu 4: Hòa tan 13,8 gam hỗn hợp Al và Fe bằng dung dịch HNO3 dư thu được 7,84 lít khí NO (đktc, là sản phẩm khử duy nhất) và dung dịch chứa m gam muối. a. Viết các phương trình hóa học xảy ra? b. Tính khối lượng mỗi kim loại trong hỗn hợp đầu. c. Tính m. Mn giải hộ e vs ạ
X là hỗn hợp bột kim loại Cu và Fe, trong đó Fe chiếm 40% khối lượng. Hòa tan m gam X bằng 200 ml dung dịch HNO3 2M, thu được khí NO duy nhất, dung dịch Y và còn lại 0,7m gam kim loại. Khối lượng muối khan trong dung dịch Y là A. 54 gam B. 64 gam C. 27 gam D. 81 gam
Đọc tiếp
X là hỗn hợp bột kim loại Cu và Fe, trong đó Fe chiếm 40% khối lượng. Hòa tan m gam X bằng 200 ml dung dịch HNO3 2M, thu được khí NO duy nhất, dung dịch Y và còn lại 0,7m gam kim loại. Khối lượng muối khan trong dung dịch Y là
A. 54 gam
B. 64 gam
C. 27 gam
D. 81 gam
giúp em với cho 10,95 gam hỗn hợp gồm Al và Cu tác dụng vừa đủ V ml dung dịch HNO3 2M thu được 3,36 lít khí duy nhất không màu hóa nâu trong không khí (đktc) và dung dịch A a)tính % khối lượng từng kim loại trong hỗn hợp b)tính thể tích của dung dịch HNO3 đã dùng
Hòa tan hoàn toàn 13,8 gam hỗn hợp A gồm hai kim loại Fe, Al vào 750 ml dung dịch HCl 1,6M (D = 1,1g/ml) thu được 10,08 lít khí (đktc) và dung dịch B.
Tính phần trăm về khối lượng mỗi kim loại trong hỗn hợp A.
Hoà tan hoàn toàn 16,5 gam hỗn hợp A gồm Fe và Al vào 500 dung dịch HCl 2,5M (d =1,1g/ml) thu được 13,44 lít H 2 (đktc) và dung dịch B. Tính % khối lượng mỗi kim loại trong hỗn hợp A
cho 3,39 gam hỗn hợp Al , Cu tác dụng vừa đủ vơi dung dịch HNO3 5% thu được 2,24 lít NO ( đktc) ( sản phẩm khử duy nhất) và dung dịch X a) Tính % khối lượng mỗi kim loại trong hỗn hợp đầu b) Cô cạn dung dịch X , sau đó tiến hành nung toàn bộ lượng muối nitrat đó trong bình kín không chưa không khí , sau khi phản ứng hoàn toàn thu được m gam chất rắn . Tính m
a) Gọi x và y lần lượt là số mol của Al và Cu.
BTKL: 27x+64y=3,39. (1)
BTe: 3x+2y=3.0,1. (2)
Từ (1) và (2), suy ra x=0,09 và y=0,015, suy ra %mAl\(\approx\)71,68% và %mCu\(\approx\)28,32%.
b) Dung dịch sau khi cô cạn chứa Al3+ (0,09 mol), Cu2+ (0,015 mol) và NO3- (0,3 mol). Chất rắn sau khi nung gồm Al2O3 (0,045 mol) và CuO (0,015 mol). Giá trị m là 5,79 gam.
Đúng 0
Bình luận (0)